邻位交叉效应


在有机化学中,邻位交叉(英语:Gauche)指的是在两相邻基团的二面角为60°下产生的构象异构。国际纯粹与应用化学联合会(IUPAC)定义邻位交叉的基团需倾斜对齐连接相邻原子的基团(倾斜对齐即:经旋转后可以对齐)。[1]
在立体化学中,邻位交叉的相互作用会阻碍化学键的转动。以丁烷为例,它有两种可能的交错式构象(稳定平衡状态),对应不同的势能,两个甲基可能呈反式(英语:Anti)构象,或者彼此间二面角为60°。后者两甲基即为邻位交叉,并且甲基间邻位交叉相互作用产生的相对势能为3.8KJ/mol。一般来说邻位交叉的旋转异构物较反式的旋转异构物来得不稳定。
邻位交叉效应[编辑]
在一些特定的化合物中,可能出现邻位交叉的旋转异构物较反式的旋转异构物更为稳定的反常情况。这一现象被称为邻位交叉效应。[2] 例如:1,2-二氟乙烷(H2FCCFH2)受邻位交叉效应影响,邻位交叉的旋转异构物较反式的旋转异构物来得稳定。在气态下,前者势能大约比后者低2.4-3.4 KJ/mol。另一个例子是1,2-二甲氧基乙烷。
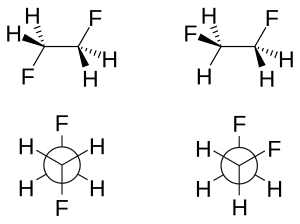

在超共轭效应模型中,认为稳定邻位交叉异构物的原因是C-H的σ成键轨道提供电子密度给C-F的σ*反键轨道。由于氟的电负性较大,因此C-H的σ轨域是比C-F的σ轨域更好的电子供体,而C-F的σ*轨域是比C-H的σ*轨道更好的电子受体。只有邻位交叉构型才能允许较好的供体与受体有好的重叠。
在弯曲键模型中,二氟乙烷的邻位交叉效应是由于氟的电负性大,增加了两个C-F上p轨域的性质,导致中央C-C键结上下左右面的电子密度增加,如果为邻位交叉构型则结果所产生的轨域重叠减少可由弯曲键的形成进行部分补偿。以这两种模式来说,二氟乙烷的邻位交叉效应的主要原因通常认为是超共轭效应。[3][4]
两种旋转异构物的分子结构可以经由高分辨率的红外光谱加上电脑的处理而得。[2] 根据上述的模型,反式旋转异构物C-C键的键长比较长(154.1 pm,邻位交叉旋转异构物为150 pm),由于邻位交叉旋转异构物氟原子间立体空间上的斥力,增加了C-C-F的键角(3.2°),也增加F-C-C-F的二面角(从理论上的60°变成71°)。
对1,2-二氟-1,2-二苯基乙烷(相当于1,2-二氟乙烷中两个氢被苯基取代的产物)的X射线衍射研究和质子耦合常数的测定表明,在(1R,2S)-1,2-二氟-1,2-二苯基乙烷及其对映体中,两个苯基采取反式构象而两个氟原子采取邻位交叉构象。而在(1R,2R)-1,2-二氟-1,2-二苯基乙烷中,苯基和氟原子均采取邻位交叉构象。[5]根据计算结果,这一构象比反式构象稳定0.88KJ/mol。
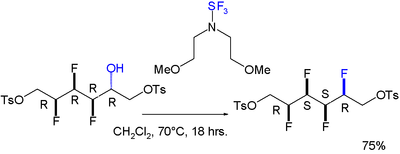
有文献报道了在一个全顺式四氟代的分子中观察到了邻位交叉效应。该分子中最后一个氟原子由以下反应引入:[6]
此外由于反式和邻位交叉异构物的极性相差很大,因此邻位交叉效应受溶剂效应的影响也很大。例如:2,3-二硝基-2,3-二甲基丁烷,其固态只存在邻位交叉异构物,而其在苯溶液中邻位交叉异构物占79%,但四氯化碳溶液中邻位交叉异构物占42%。[7]
相关链接[编辑]
参考[编辑]
- ^ 国际纯化学和应用化学联合会,化学术语概略,第二版。(金皮书)(1997)。在线校正版: (2006–) "gauche"。doi:10.1351/goldbook.G02593
- ^ 2.0 2.1 Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser J. Am. Chem. Soc.; 1997; 119(20) pp 4789 - 4790; (Communication) doi:10.1021/ja963819e
- ^ Goodman, L.; Gu, H.; Pophristic, V.. Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion. J. Phys. Chem. A. 2005, 109, 1223-1229. doi:10.1021/jp046290d
- ^ David O'Hagan. Understanding organofluorine chemistry. An introduction to the C–F bond. Chem. Soc. Rev. 2008 doi:10.1039/b711844a
- ^ The vicinal difluoro motif: The synthesis and conformation of erythro- and threo- diastereoisomers of 1,2-difluorodiphenylethanes, 2,3-difluorosuccinic acids and their derivatives O'Hagan D, Rzepa H, Schuler M, Slawin A Beilstein Journal of Organic Chemistry, 2006 2:19 ( 2 October 2006 ) doi:10.1186/1860-5397-2-19
- ^ Enantioselective Synthesis of an All-syn Four Vicinal Fluorine Motif Luke Hunter, David O'Hagan, and Alexandra M. Z. Slawin J. Am. Chem. Soc.; 2006; 128(51) pp 16422 - 16423; (Communication) doi:10.1021/ja066188p
- ^ Smith, Michael. B.; March, J. March's Advanced Organic Chemistry, 7th edition. Wiley, 2001.p177-178 ISBN 978-0-470-46259-1
